Si è tenuto lo scorso 23 febbraio, il terzo incontro dell’Advisory Board dell’Osservatorio Innovazione Digitale in Sanità del Politecnico di Milano. L’evento, interamente in streaming, si è focalizzato sul tema della “Digital Care e delle Terapie Digitali come applicazioni innovative per la cura del cittadino/paziente”. L’appuntamento ha visto tra i relatori anche Massimo Beccaria, Presidente di AdvicePharma Group, intervenuto sul tema della “Creazione e implementazione di una Terapia Digitale in Europa”.
Beccaria ha definito il perimetro entro cui si muovono le DTx, che in Europa sono classificate come Software as a Medical Device (SaMD) e con il Regolamento europeo per i dispositivi medici (European Medical Devices Regulation – MDR) del 25 maggio 2017, la cui applicazione è attesa per maggio 2021, vedranno la classificazione come Medical Device (MD) in conformità del rischio associato.
La TimeLine di una terapia digitale
Una riflessione legata allo sviluppo delle DTx è quella sulla timeline, che si allinea a quella di una qualsiasi terapia finalizzata al trattamento di una patologia. In generale, la DTx parte dal “Time zero”, ossia il momento della costituzione del Gruppo di progetto, con la creazione del documento di progetto contenente le finalità del MD (prima bozza di protocollo clinico).
Dopo 3 mesi il documento di specifica è terminato e si inizia lo sviluppo del device, che passa per il Candidate study ready software (in sei mesi) e in 18 mesi, indicativamente, si arriva alla fine del clinical trial. Il dato, in questo caso, è stimato in quanto il trial per la marcatura CE dipende dal device e dalla sua categoria di rischi/utilizzo. In due anni, in ogni caso, si dovrebbe arrivare alla sottomissione all’ente certificatore.
Vantaggi e impieghi della terapia digitale
I vantaggi delle DTx sono evidenti già dalle prime sperimentazioni, e vanno dai benefici dal punto di vista “behavioural” (comportamentale), all’efficacia di lungo periodo.
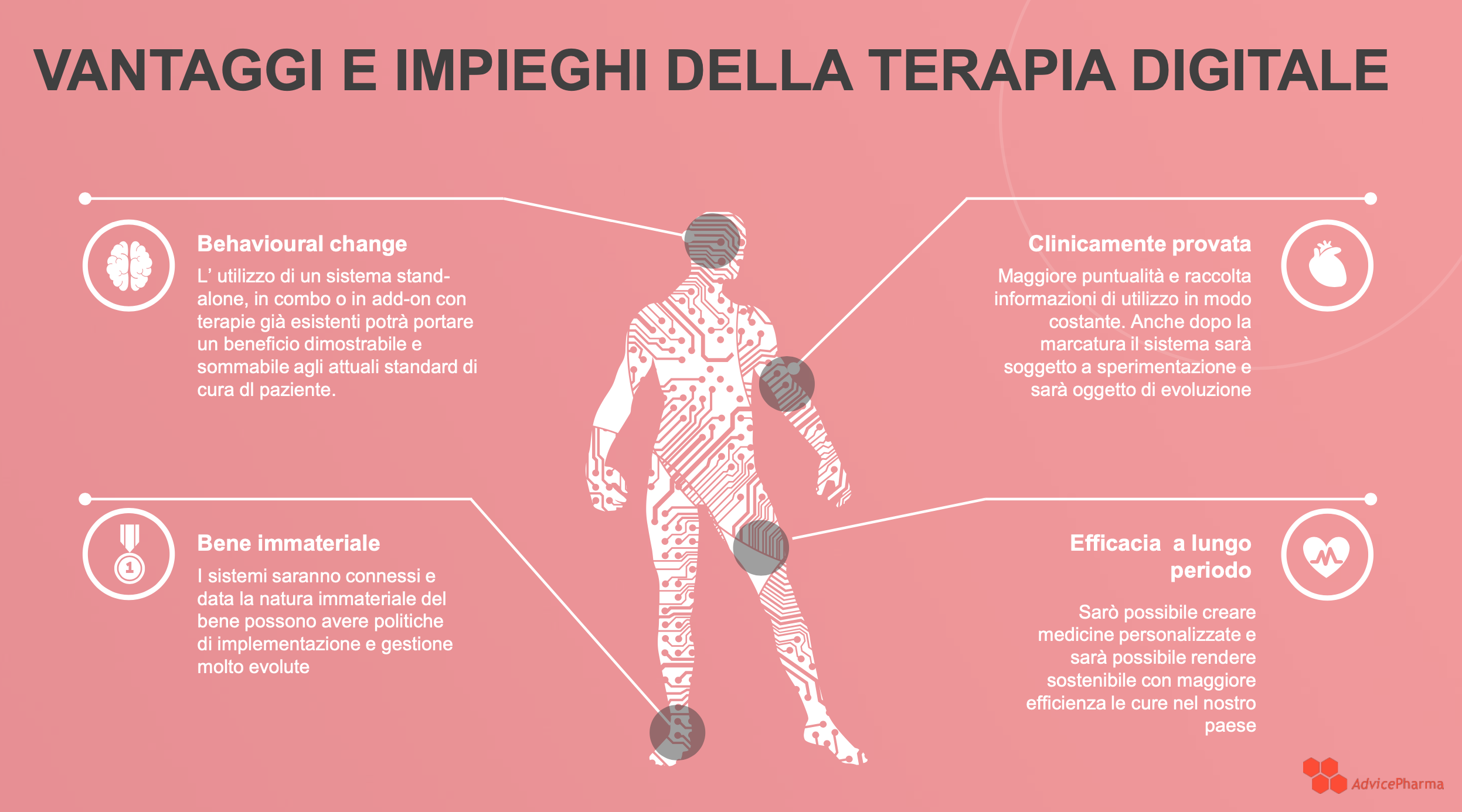
Restano, tuttavia, alcune questioni chiave da dirimere, che comprendono l’assenza di chiare linee guida a livello italiano sull’applicazione e la somministrazione delle DTx in ambito sanitario, le politiche di rimborso e la gestione in combinazione con farmaci.
Gli obblighi dei “fabbricanti” di DTx si possono in ogni caso riassumere con tre parole chiave: sicurezza, beneficio e qualità.
In particolare le DTx devono specificare la destinazione d’uso e il SaMD deve essere costruito secondo le norme ISO 13485, ISo 14 971 IEC 62304.
AdvicePharma con la certificazioneISO 13485 è, a oggi, la prima Contract Research Organization (CRO) italiana autorizzata alla produzione di Digital Therapeutics come SaMD.
L’Osservatorio Innovazione Digitale in Sanità del PoliMi
L’incontro del 23 febbraio si è inserito nell’ambito del percorso di ricerca dell’Osservatorio Innovazione Digitale in Sanità del PoliMi. Giunto alla 14esima edizione, l’Osservatorio si pone l’obiettivo di analizzare e promuovere il ruolo delle tecnologie digitali a supporto del miglioramento e dell’innovazione del sistema sanitario. Nell’ambito della Ricerca 2020-2021, l’Osservatorio si è impegnato a raggiungere una serie di obiettivi, che vanno dalla stima della spesa per la Sanità digitale in Italia all’analisi del livello di diffusione delle tecnologie digitali riguardanti la Connected Care; dal tema dell’Intelligenza Artificiale in sanità, a quello del digitale a supporto del patient Empowerment ed Engagement e della “digital readiness” degli operatori sanitari, passando per gli approfondimenti legati alle soluzioni di Telemedicina e allo sviluppo di Digital Therapeutics.
La Ricerca dell’Osservatorio, si legge sul sito, si basa su un’analisi empirica che, attraverso survey e studi di caso, coinvolge ogni anno circa 200 attori tra CIO, Direttori Generali, Direttori Amministrativi, Direttori Sanitari e Socio Sanitari, a cui si aggiungono referenti regionali, Medici di Medicina Generale e un campione statisticamente rappresentativo di cittadini italiani.
I risultati di questa ricerca saranno presentati nel corso di un Convegno calendarizzato per il 26 maggio 2021.
Per maggiori informazioni sull’Osservatorio e sulle iniziative della School of Management del PoliMi vai a questo link.






